Cultivo de tejidos l: Propagación de muchas plantas en un espacio pequeño
Hay más de una forma de propagar una planta. La cría a partir de semillas, esquejes o injertos son métodos probados y probados bien conocidos en los anales de la horticultura. El cultivo de tejidos reciente es un método que puede producir una gran cantidad de plántulas en un espacio relativamente pequeño. Aunque técnicamente son más avanzados, los métodos de cultivo de tejidos pueden producir más plantas genéticamente idénticas en menos tiempo de lo que es posible con la propagación vegetativa a partir de plantas madre mediante esquejes.
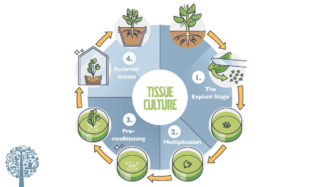
En el cultivo de tejidos vegetales, como sugiere su nombre, el tejido vegetal se desinfecta, se tritura y se coloca en un medio de crecimiento diseñado para promover la proliferación celular. Luego se induce el cultivo para promover el crecimiento de los brotes. Una vez que aparecen los brotes, otro tratamiento inicia el desarrollo de las raíces. Luego, los brotes enraizados se extraen del entorno de cultivo de tejidos y se trasplantan al suelo u otro medio típico. Después de un período de aclimatación, las plantas jóvenes están listas para sobrevivir por sí mismas. El proceso suele dividirse en tres o cuatro fases. Aunque los procedimientos para el cultivo de tejidos vegetales varían, lo siguiente proporciona una descripción general de la técnica según el laboratorio.
Etapa 1 – La fase de explante
Comience con un trozo de tallo, hoja, tejido meristemático o cualquier otra parte de la planta. Los protocolos exactos varían, pero el material se retira de la planta y se somete a una secuencia de desinfección que incluye remojo y enjuague en una combinación de isopropanol, solución de lejía y agua esterilizada. Los explantes se colocan en un medio que contiene una fuente de carbono, nutrientes esenciales y una de las hormonas vegetales auxina. La fuente de carbono suele ser la sacarosa y la hormona puede ser el ácido indol-3-butírico (IBA), el ácido 2,4-diclorofenoxiacético (2,4 D) o una de varias otras auxinas. Los explantes a menudo comienzan a crecer como una masa indiferenciada de células llamada callo. A veces, los brotes comienzan a formarse a partir del tejido del callo. La hormona sintética 2.4 D promueve particularmente bien el crecimiento del tejido corneal indiferenciado.
Nivel 2 – multiplicación
En la Etapa II, el objetivo es producir brotes ramificando brotes existentes o formando nuevos brotes. La proporción de citoquininas a auxinas se ajusta para promover la iniciación de nuevos brotes a partir del tejido del callo. Las citoquininas promueven la división celular. Aunque se requiere una alta concentración de auxina para iniciar y mantener el crecimiento del callo en la etapa de explante, el aumento de la proporción de citoquinina a auxina desencadena la organogénesis de los brotes en la etapa II. Todos los brotes que surgen en el medio de la Etapa I se diseccionan y separan. Luego se trasplantan a un medio que contiene una baja concentración de auxina más la adición de kinetina, bencilaminopurina (BA), isopentiladenina (2iP) u otras citoquininas. Si no se forman brotes en el medio de la Etapa I, se siembran submuestras de tejido calloso en el medio de la Etapa II para inducir la organogénesis de los brotes. A veces, solo se formarán uno o dos brotes y, a veces, se formarán una docena o más, según la especie de planta y las condiciones de crecimiento.
Durante la Fase II, se puede realizar el verdadero poder del cultivo de tejidos. El paso de propagación se puede repetir hasta que haya disponible cualquier número de brotes. Cada ciclo de propagación dura entre uno y varios meses, pero es posible producir miles de brotes en un espacio pequeño con relativa rapidez.
Nivel 3 – preacondicionamiento
Esto también podría denominarse la fase de “enraizamiento”. Una vez que se han formado brotes sanos en el medio de propagación, se escinden y se trasplantan a un medio que carece de citoquinina pero que a su vez aporta auxina, que es esencial para la organogénesis de la raíz en estas condiciones. La auxina se puede incluir en el medio, o cada brote se puede sumergir en hormona de enraizamiento antes de adherirse al nuevo medio. Una vez que aparecen las raíces, se permite que las plantas crezcan hasta que haya suficiente masa de raíces para extenderse a los brotes.

Nivel 4 – aclimatación
Una vez que las plántulas se han formado con un buen desarrollo de brotes y raíces in vitro, es hora de sacarlos de los recipientes de cultivo y llevarlos al mundo real. Este es un excelente momento para ser selectivo, seleccionando solo plantas con un fuerte desarrollo de raíces y brotes para la transferencia de la etapa final. A menudo, las plantas silvestres y rebeldes dan como resultado los trasplantes más saludables y con mayor capacidad de supervivencia. Las plántulas bien enraizadas se cortan, dividen y plantan en macetas en el suelo. Las plantas jóvenes son sensibles a la luz, el estrés hídrico y las enfermedades, ya que hasta ahora han llevado una vida protegida. Las plantas deben mantenerse en un ambiente húmedo para evitar una alta tasa de pérdida. Podemos hacer esto colocando una pequeña cúpula de humedad de un vaso o bolsa de plástico transparente sobre cada planta en maceta. Durante unas pocas semanas bajo iluminación fluorescente o LED, sin luz solar directa ni luces fuertes, las cámaras de humedad se airean gradualmente para permitir una reducción de la humedad hasta que las plantas puedan sobrevivir por sí mismas en condiciones de crecimiento normales.
Una clave para el éxito en el cultivo de tejidos vegetales es mantener las condiciones de crecimiento axénico. Axenic significa “sin un extraño”, lo que significa que los únicos organismos permitidos en los cultivos son las plantas y nada más. Los medios nutritivos utilizados en el cultivo de tejidos son perfectos para apoyar el crecimiento no solo de plantas sino también de bacterias y hongos. Los microbios destruirán rápidamente las plantas tiernas jóvenes si se les da la oportunidad. Por esta razón, se recomienda una campana de flujo laminar con un filtro de partículas de alta eficiencia (HEPA) para forzar el aire estéril sobre el área de trabajo durante la operación cuando los cultivos están expuestos. Incluso una guantera de plexiglás sin filtrar reduce la contaminación al evitar que las partículas caigan sobre las plantas y el medio de cultivo desde arriba durante el procesamiento. Sin una campana de flujo, se puede lograr cierto éxito cuando se trabaja rápidamente en un espacio con poco flujo de aire. Limpiar a fondo las superficies de trabajo y el equipo con isopropanol al 70 % y/o flamear todas las herramientas y recipientes de cultivo de vidrio. Por supuesto, los técnicos deben usar guantes, una bata de laboratorio limpia (sin mangas cortas), una red para el cabello y, si es necesario, un protector para la barba para reducir al máximo la posibilidad de contaminación.
Costos
Entonces, ¿cuánto cuesta ingresar al cultivo de tejidos vegetales? Como mínimo, necesitará un esterilizador/olla a presión, utensilios de vidrio o plástico (frascos, etc.), dispositivos de medición (balanza electrónica o de triple haz, probeta graduada), ingredientes para medios de cultivo y hormonas, y una rejilla de cultivo con luces. Una olla instantánea y frascos de comida para bebés pueden ayudarlo a comenzar. Si aún no tiene el equipo de laboratorio básico, espere gastar $ 300- $ 500 por adelantado. Como la mayoría de los procedimientos técnicos de laboratorio que involucran seres vivos, se necesita práctica y experiencia para tener éxito. Mantenga registros precisos en un cuaderno y no se dé por vencido hasta que funcione de manera confiable. Nunca olvidarás tu primera in vitro plántula